Minúsculos nanotubos cerebrais descobertos pela Johns Hopkins podem espalhar a doença de Alzheimer
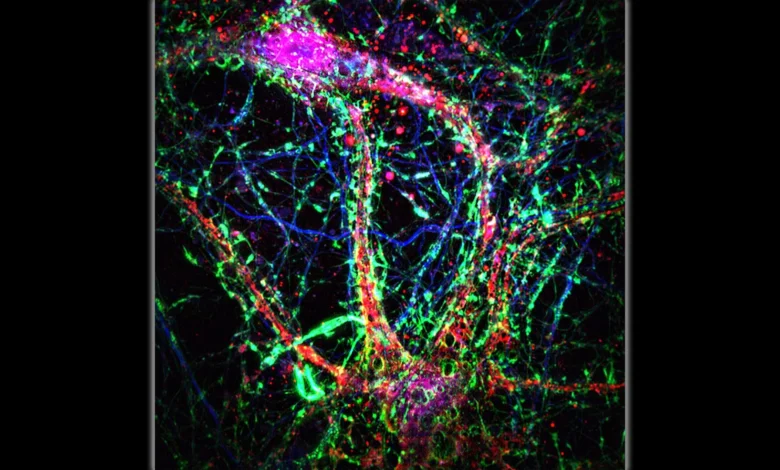
Pesquisadores da Johns Hopkins Medicine descobriram como os cérebros dos mamíferos desenvolvem redes complexas de microtúbulos que movem toxinas para dentro e para fora das células cerebrais.
Seus experimentos, que usaram camundongos geneticamente modificados e equipamentos avançados de imagem, foram apoiados pelos Institutos Nacionais de Saúde e publicados em 2 de outubro. Ciência. Segundo a equipa, a descoberta aprofunda a compreensão científica de como a doença de Alzheimer e outras doenças neurodegenerativas se desenvolvem, proporcionando caminhos potenciais para novos tratamentos.
No estudo, os cientistas observaram que esses pequenos tubos, chamados nanotubos, ajudam os neurônios a eliminar pequenas moléculas tóxicas, principalmente beta-amilóide. Uma das características definidoras da doença de Alzheimer é que esta proteína pode aglomerar-se em placas pegajosas.
“As células precisam de se livrar de moléculas tóxicas e, ao criarem um nanotubo, podem passar esta molécula tóxica para uma célula vizinha”, diz Heungbae Kwan, professor associado de neurologia na Escola de Medicina da Universidade Johns Hopkins. “Infelizmente, também espalha proteínas prejudiciais para outras partes do cérebro”.
Com a ajuda de microscópios poderosos e imagens de células vivas, a equipe observou que os neurônios formam extensões longas e finas entre seus dendritos – as projeções ramificadas que conectam as células cerebrais. Esses “nanotubos dendríticos”, como os pesquisadores os chamam, parecem transmitir moléculas prejudiciais de um neurônio para outro.
“As estruturas longas e finas em forma de coluna desses nanotubos dendríticos permitem a rápida transferência de informações de neurônio para neurônio”, diz Guan. “Esses nanotubos podem transportar cálcio, íons ou moléculas tóxicas e são ideais para transmitir informações às células à distância”.
Simulações computacionais deste processo imitam os estágios iniciais da formação de amiloide, ou “amiloidose precoce”, e o que os pesquisadores descrevem como uma “camada de junção nanotubular” que acrescenta uma nova dimensão à forma como as células cerebrais se comunicam.
Guan observa que esses insights poderiam ajudar os cientistas a refinar abordagens para o tratamento da doença de Alzheimer e condições semelhantes.
Para investigar este fenómeno, os investigadores recolheram pequenas amostras de tecido cerebral de ratos saudáveis e examinaram-nas com um microscópio de alta resolução, o que lhes permitiu visualizar os nanotubos com detalhes notáveis e acompanhar como estes movem os materiais entre os neurónios.
Eles compararam essas amostras com tecido cerebral de camundongos geneticamente modificados para desenvolver estruturas amilóides semelhantes às da doença de Alzheimer.
Os pesquisadores dizem que o número de nanotubos aumentou nos cérebros de camundongos com doença de Alzheimer aos três meses de idade. Aos seis meses de idade, o número de nanotubos em camundongos normais e naqueles com doença de Alzheimer começou a se igualar.
Ao observar de perto os neurônios humanos (amostrados com permissão do banco de dados de microscopia eletrônica disponível publicamente), os cientistas descobriram nanotubos se formando entre os neurônios semelhantes aos produzidos por ratos de laboratório.
Em experimentos futuros, diz Guan, a equipe se concentrará em saber se existem redes de nanotubos em grande escala em outros tipos de células além dos neurônios no cérebro. Em última análise, ele quer projetar um experimento no qual os pesquisadores criem um nanotubo para ver como ele afeta o estado das células.
Com esse conhecimento, diz Guan, é possível um dia aumentar ou diminuir a produção de nanotubos para proteger o cérebro.
“Este trabalho poderia ser usado para projetar um tratamento potencial baseado em como os nanotubos são produzidos – aumentando ou diminuindo sua formação – dependendo do estágio da doença”, diz Guan.
O financiamento para esta pesquisa foi fornecido pelos Institutos Nacionais de Saúde (DP1MH119428 e R01NS138176).
Investigadores adicionais que conduziram o estudo foram Minhyuk Chang, Sarah Crussel, Juhyun Kim, Daniel Lee, Alec Merodeo e Jaeyoung Kwon da Johns Hopkins; Lakshmi Kumar Parajuli e Shigeo Okabe da Universidade de Tóquio, Japão.
